Considere um copo de vidro de 100 g contendo 200 g de água líquida, ambos inicialmente em equilíbrio térmico a 20 ºC.

O copo e a água líquida foram aquecidos até o
equilíbrio térmico a 50 ºC, em um ambiente fechado por paredes
adiabáticas, com vapor de água inicialmente a 120 ºC. A tabela apresenta
valores de calores específicos e latentes das substâncias envolvidas
nesse processo.

Considerando os dados da tabela, que todo o calor
perdido pelo vapor tenha sido absorvido pelo copo com água líquida e que
o processo tenha ocorrido ao nível do mar, calcule:
a) a quantidade de calor, em cal, necessária para elevar a temperatura do copo com água líquida de 20 ºC para 50 ºC.
b) a massa de vapor de água, em gramas, necessária
para elevar a temperatura do copo com água líquida até atingir o
equilíbrio térmico a 50 ºC.
a) Dados:
Água:
mA: 200 g
cA: 1 cal/g · ºC
θi: 20º C
θf: 50º C
Copo:
mC: 100 g
cC: 0,2 cal/g · ºC
θi: 20º C
θf: 50º C
A quantidade de calor recebido (QR) pelo conjunto copo mais água é:
QR = QC + QA
QR = mC · cC · (θf – θi) + mA · cA · (θf – θi)
QR = 100 · 0,2 · (50 – 20) + 200 · 1 · (50 – 20)
QR = 6600 cal
b) Dados:
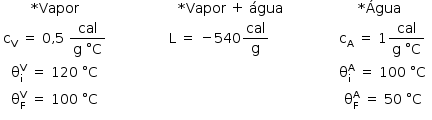
Por se tratar de um sistema termicamente isolado:
Água:
mA: 200 g
cA: 1 cal/g · ºC
θi: 20º C
θf: 50º C
Copo:
mC: 100 g
cC: 0,2 cal/g · ºC
θi: 20º C
θf: 50º C
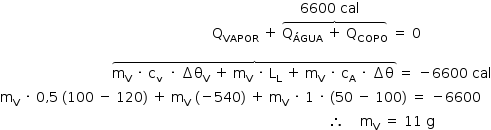
A quantidade de calor recebido (QR) pelo conjunto copo mais água é:
QR = QC + QA
QR = mC · cC · (θf – θi) + mA · cA · (θf – θi)
QR = 100 · 0,2 · (50 – 20) + 200 · 1 · (50 – 20)
QR = 6600 cal
b) Dados:
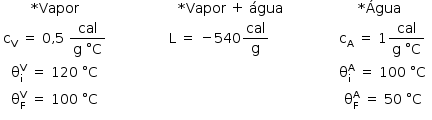
Por se tratar de um sistema termicamente isolado:

