Analise a tabela, que fornece valores aproximados de pH e pOH de soluções aquosas a 25 ºC.
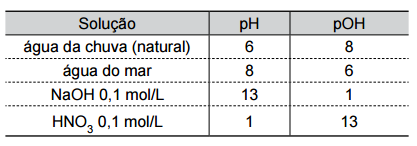
a) Classifique como ácida ou alcalina cada uma das soluções apresentadas na tabela.
b) Considere que foi acrescentada água em amostras de 100 mL de HNO3
0,1 mol/L e de 100 mL da solução de NaOH 0,1 mol/L, até que o volume de
cada amostra completasse 1 litro. Calcule, a 25 o C, o pH da solução de
HNO3 e o pOH da solução de NaOH após a diluição.
a) Soluções ácidas são aquelas de pH < 7 a 25 °C, ou seja, água da chuva e HNO3 0,1 mol/L.
Soluções alcalinas apresentam pH > 7 a 25 °C, ou seja, água do mar e NaOH 0,1 mol/L.
b)
Solução ácida:
Concentração inicial (Ci) = 0,1 mol/L Concentração final (Cf) = ?
Volume inicial (Vi) = 100 mL Volume final (Vf) = 1000 mL
Ci · Vi = Cf · Vf
0,1 · 100 = Cf · 1000
Cf = 0,01 mol/L
Como o HNO3 é ácido forte e está 100% ionizado, tem-se:
![«math style=¨font-family:Tahoma¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle mathsize=¨14px¨»«mtable»«mtr»«mtd»«msub»«mi»HNO«/mi»«mn»3«/mn»«/msub»«mo»(«/mo»«mi»aq«/mi»«mo»)«/mo»«/mtd»«mtd»«mo»§#x2192;«/mo»«/mtd»«mtd»«msup»«mi mathvariant=¨normal¨»H«/mi»«mo»+«/mo»«/msup»«mo»(«/mo»«mi»aq«/mi»«mo»)«/mo»«/mtd»«mtd»«mo»+«/mo»«/mtd»«mtd»«msup»«msub»«mi»NO«/mi»«mn»3«/mn»«/msub»«mo»-«/mo»«/msup»«mo»(«/mo»«mi»aq«/mi»«mo»)«/mo»«/mtd»«/mtr»«mtr»«mtd»«menclose notation=¨downdiagonalstrike updiagonalstrike¨»«mn»0«/mn»«mo»,«/mo»«mn»01«/mn»«mo»§#xA0;«/mo»«mi»mol«/mi»«mo»/«/mo»«mi mathvariant=¨normal¨»L«/mi»«/menclose»«/mtd»«mtd/»«mtd»«mn»0«/mn»«mo»,«/mo»«mn»01«/mn»«mo»§#xA0;«/mo»«mi»mol«/mi»«mo»/«/mo»«mi mathvariant=¨normal¨»L«/mi»«/mtd»«mtd/»«mtd»«mn»0«/mn»«mo»,«/mo»«mn»01«/mn»«mo»§#xA0;«/mo»«mi»mol«/mi»«mo»/«/mo»«mi mathvariant=¨normal¨»L«/mi»«/mtd»«/mtr»«/mtable»«mspace linebreak=¨newline¨/»«mo»[«/mo»«msup»«mi mathvariant=¨normal¨»H«/mi»«mo»+«/mo»«/msup»«mo»]«/mo»«mo»§#xA0;«/mo»«mo»=«/mo»«mo»§#xA0;«/mo»«mn»0«/mn»«mo»,«/mo»«mn»01«/mn»«mo»§#xA0;«/mo»«mi»mol«/mi»«mo»/«/mo»«mi mathvariant=¨normal¨»L«/mi»«mo»§#xA0;«/mo»«mo»=«/mo»«mo»§#xA0;«/mo»«msup»«mn»10«/mn»«mrow»«mo»-«/mo»«mn»2«/mn»«/mrow»«/msup»«mo»§#xA0;«/mo»«mi mathvariant=¨normal¨»M«/mi»«mo»§#xA0;«/mo»«mo»§#x21D2;«/mo»«mo»§#xA0;«/mo»«mi mathvariant=¨bold¨»pH«/mi»«mo mathvariant=¨bold¨»§#xA0;«/mo»«mo mathvariant=¨bold¨»=«/mo»«mo mathvariant=¨bold¨»§#xA0;«/mo»«mn mathvariant=¨bold¨»2«/mn»«mo mathvariant=¨bold¨»§#xA0;«/mo»«mo mathvariant=¨bold¨»(«/mo»«mi mathvariant=¨bold¨»ap§#xF3;s«/mi»«mo mathvariant=¨bold¨»§#xA0;«/mo»«mi mathvariant=¨bold¨»a«/mi»«mo mathvariant=¨bold¨»§#xA0;«/mo»«mi mathvariant=¨bold¨»dilui§#xE7;§#xE3;o«/mi»«mo mathvariant=¨bold¨»)«/mo»«/mstyle»«/math»](https://anglo.plurall.net/sites/all/libraries/ckeditor//plugins/ckeditor_wiris/integration/showimage.php?formula=d6de9ee5fc09d83731e6682b6f363c82.png)
Solução alcalina:
Concentração inicial (Ci) = 0,1 mol/L Concentração final (Cf) = ?
Volume inicial (Vi) = 100 mL Volume final (Vf) = 1000 mL
Ci · Vi = Cf · Vf
0,1 · 100 = Cf · 1000
Cf = 0,01 mol/L
Como o NaOH é base forte e está 100% dissociada, tem-se:
![«math style=¨font-family:Tahoma¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle mathsize=¨14px¨»«mtable»«mtr»«mtd»«mi»NaOH«/mi»«mo»(«/mo»«mi»aq«/mi»«mo»)«/mo»«/mtd»«mtd»«mo»§#x2192;«/mo»«/mtd»«mtd»«msup»«mi»Na«/mi»«mo»+«/mo»«/msup»«mo»(«/mo»«mi»aq«/mi»«mo»)«/mo»«/mtd»«mtd»«mo»+«/mo»«/mtd»«mtd»«msup»«mi»OH«/mi»«mo»-«/mo»«/msup»«mo»(«/mo»«mi»aq«/mi»«mo»)«/mo»«/mtd»«/mtr»«mtr»«mtd»«menclose notation=¨downdiagonalstrike updiagonalstrike¨»«mn»0«/mn»«mo»,«/mo»«mn»01«/mn»«mo»§#xA0;«/mo»«mi»mol«/mi»«mo»/«/mo»«mi mathvariant=¨normal¨»L«/mi»«/menclose»«/mtd»«mtd/»«mtd»«mn»0«/mn»«mo»,«/mo»«mn»01«/mn»«mo»§#xA0;«/mo»«mi»mol«/mi»«mo»/«/mo»«mi mathvariant=¨normal¨»L«/mi»«/mtd»«mtd/»«mtd»«mn»0«/mn»«mo»,«/mo»«mn»01«/mn»«mo»§#xA0;«/mo»«mi»mol«/mi»«mo»/«/mo»«mi mathvariant=¨normal¨»L«/mi»«/mtd»«/mtr»«/mtable»«mspace linebreak=¨newline¨/»«mo»[«/mo»«msup»«mi»OH«/mi»«mo»-«/mo»«/msup»«mo»]«/mo»«mo»§#xA0;«/mo»«mo»=«/mo»«mo»§#xA0;«/mo»«mn»0«/mn»«mo»,«/mo»«mn»01«/mn»«mo»§#xA0;«/mo»«mi»mol«/mi»«mo»/«/mo»«mi mathvariant=¨normal¨»L«/mi»«mo»§#xA0;«/mo»«mo»=«/mo»«mo»§#xA0;«/mo»«msup»«mn»10«/mn»«mrow»«mo»-«/mo»«mn»2«/mn»«/mrow»«/msup»«mo»§#xA0;«/mo»«mi mathvariant=¨normal¨»M«/mi»«mo»§#xA0;«/mo»«mo»§#x21D2;«/mo»«mo»§#xA0;«/mo»«mi mathvariant=¨bold¨»pOH«/mi»«mo mathvariant=¨bold¨»§#xA0;«/mo»«mo mathvariant=¨bold¨»=«/mo»«mo mathvariant=¨bold¨»§#xA0;«/mo»«mn mathvariant=¨bold¨»2«/mn»«mo mathvariant=¨bold¨»§#xA0;«/mo»«mo mathvariant=¨bold¨»(«/mo»«mi mathvariant=¨bold¨»ap§#xF3;s«/mi»«mo mathvariant=¨bold¨»§#xA0;«/mo»«mi mathvariant=¨bold¨»a«/mi»«mo mathvariant=¨bold¨»§#xA0;«/mo»«mi mathvariant=¨bold¨»dilui§#xE7;§#xE3;o«/mi»«mo mathvariant=¨bold¨»)«/mo»«/mstyle»«/math»](https://anglo.plurall.net/sites/all/libraries/ckeditor//plugins/ckeditor_wiris/integration/showimage.php?formula=cf05c2f7b8363f195a73e99bb897ab69.png)
Soluções alcalinas apresentam pH > 7 a 25 °C, ou seja, água do mar e NaOH 0,1 mol/L.
b)
Solução ácida:
Concentração inicial (Ci) = 0,1 mol/L Concentração final (Cf) = ?
Volume inicial (Vi) = 100 mL Volume final (Vf) = 1000 mL
Ci · Vi = Cf · Vf
0,1 · 100 = Cf · 1000
Cf = 0,01 mol/L
Como o HNO3 é ácido forte e está 100% ionizado, tem-se:
![«math style=¨font-family:Tahoma¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle mathsize=¨14px¨»«mtable»«mtr»«mtd»«msub»«mi»HNO«/mi»«mn»3«/mn»«/msub»«mo»(«/mo»«mi»aq«/mi»«mo»)«/mo»«/mtd»«mtd»«mo»§#x2192;«/mo»«/mtd»«mtd»«msup»«mi mathvariant=¨normal¨»H«/mi»«mo»+«/mo»«/msup»«mo»(«/mo»«mi»aq«/mi»«mo»)«/mo»«/mtd»«mtd»«mo»+«/mo»«/mtd»«mtd»«msup»«msub»«mi»NO«/mi»«mn»3«/mn»«/msub»«mo»-«/mo»«/msup»«mo»(«/mo»«mi»aq«/mi»«mo»)«/mo»«/mtd»«/mtr»«mtr»«mtd»«menclose notation=¨downdiagonalstrike updiagonalstrike¨»«mn»0«/mn»«mo»,«/mo»«mn»01«/mn»«mo»§#xA0;«/mo»«mi»mol«/mi»«mo»/«/mo»«mi mathvariant=¨normal¨»L«/mi»«/menclose»«/mtd»«mtd/»«mtd»«mn»0«/mn»«mo»,«/mo»«mn»01«/mn»«mo»§#xA0;«/mo»«mi»mol«/mi»«mo»/«/mo»«mi mathvariant=¨normal¨»L«/mi»«/mtd»«mtd/»«mtd»«mn»0«/mn»«mo»,«/mo»«mn»01«/mn»«mo»§#xA0;«/mo»«mi»mol«/mi»«mo»/«/mo»«mi mathvariant=¨normal¨»L«/mi»«/mtd»«/mtr»«/mtable»«mspace linebreak=¨newline¨/»«mo»[«/mo»«msup»«mi mathvariant=¨normal¨»H«/mi»«mo»+«/mo»«/msup»«mo»]«/mo»«mo»§#xA0;«/mo»«mo»=«/mo»«mo»§#xA0;«/mo»«mn»0«/mn»«mo»,«/mo»«mn»01«/mn»«mo»§#xA0;«/mo»«mi»mol«/mi»«mo»/«/mo»«mi mathvariant=¨normal¨»L«/mi»«mo»§#xA0;«/mo»«mo»=«/mo»«mo»§#xA0;«/mo»«msup»«mn»10«/mn»«mrow»«mo»-«/mo»«mn»2«/mn»«/mrow»«/msup»«mo»§#xA0;«/mo»«mi mathvariant=¨normal¨»M«/mi»«mo»§#xA0;«/mo»«mo»§#x21D2;«/mo»«mo»§#xA0;«/mo»«mi mathvariant=¨bold¨»pH«/mi»«mo mathvariant=¨bold¨»§#xA0;«/mo»«mo mathvariant=¨bold¨»=«/mo»«mo mathvariant=¨bold¨»§#xA0;«/mo»«mn mathvariant=¨bold¨»2«/mn»«mo mathvariant=¨bold¨»§#xA0;«/mo»«mo mathvariant=¨bold¨»(«/mo»«mi mathvariant=¨bold¨»ap§#xF3;s«/mi»«mo mathvariant=¨bold¨»§#xA0;«/mo»«mi mathvariant=¨bold¨»a«/mi»«mo mathvariant=¨bold¨»§#xA0;«/mo»«mi mathvariant=¨bold¨»dilui§#xE7;§#xE3;o«/mi»«mo mathvariant=¨bold¨»)«/mo»«/mstyle»«/math»](https://anglo.plurall.net/sites/all/libraries/ckeditor//plugins/ckeditor_wiris/integration/showimage.php?formula=d6de9ee5fc09d83731e6682b6f363c82.png)
Solução alcalina:
Concentração inicial (Ci) = 0,1 mol/L Concentração final (Cf) = ?
Volume inicial (Vi) = 100 mL Volume final (Vf) = 1000 mL
Ci · Vi = Cf · Vf
0,1 · 100 = Cf · 1000
Cf = 0,01 mol/L
Como o NaOH é base forte e está 100% dissociada, tem-se:
![«math style=¨font-family:Tahoma¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle mathsize=¨14px¨»«mtable»«mtr»«mtd»«mi»NaOH«/mi»«mo»(«/mo»«mi»aq«/mi»«mo»)«/mo»«/mtd»«mtd»«mo»§#x2192;«/mo»«/mtd»«mtd»«msup»«mi»Na«/mi»«mo»+«/mo»«/msup»«mo»(«/mo»«mi»aq«/mi»«mo»)«/mo»«/mtd»«mtd»«mo»+«/mo»«/mtd»«mtd»«msup»«mi»OH«/mi»«mo»-«/mo»«/msup»«mo»(«/mo»«mi»aq«/mi»«mo»)«/mo»«/mtd»«/mtr»«mtr»«mtd»«menclose notation=¨downdiagonalstrike updiagonalstrike¨»«mn»0«/mn»«mo»,«/mo»«mn»01«/mn»«mo»§#xA0;«/mo»«mi»mol«/mi»«mo»/«/mo»«mi mathvariant=¨normal¨»L«/mi»«/menclose»«/mtd»«mtd/»«mtd»«mn»0«/mn»«mo»,«/mo»«mn»01«/mn»«mo»§#xA0;«/mo»«mi»mol«/mi»«mo»/«/mo»«mi mathvariant=¨normal¨»L«/mi»«/mtd»«mtd/»«mtd»«mn»0«/mn»«mo»,«/mo»«mn»01«/mn»«mo»§#xA0;«/mo»«mi»mol«/mi»«mo»/«/mo»«mi mathvariant=¨normal¨»L«/mi»«/mtd»«/mtr»«/mtable»«mspace linebreak=¨newline¨/»«mo»[«/mo»«msup»«mi»OH«/mi»«mo»-«/mo»«/msup»«mo»]«/mo»«mo»§#xA0;«/mo»«mo»=«/mo»«mo»§#xA0;«/mo»«mn»0«/mn»«mo»,«/mo»«mn»01«/mn»«mo»§#xA0;«/mo»«mi»mol«/mi»«mo»/«/mo»«mi mathvariant=¨normal¨»L«/mi»«mo»§#xA0;«/mo»«mo»=«/mo»«mo»§#xA0;«/mo»«msup»«mn»10«/mn»«mrow»«mo»-«/mo»«mn»2«/mn»«/mrow»«/msup»«mo»§#xA0;«/mo»«mi mathvariant=¨normal¨»M«/mi»«mo»§#xA0;«/mo»«mo»§#x21D2;«/mo»«mo»§#xA0;«/mo»«mi mathvariant=¨bold¨»pOH«/mi»«mo mathvariant=¨bold¨»§#xA0;«/mo»«mo mathvariant=¨bold¨»=«/mo»«mo mathvariant=¨bold¨»§#xA0;«/mo»«mn mathvariant=¨bold¨»2«/mn»«mo mathvariant=¨bold¨»§#xA0;«/mo»«mo mathvariant=¨bold¨»(«/mo»«mi mathvariant=¨bold¨»ap§#xF3;s«/mi»«mo mathvariant=¨bold¨»§#xA0;«/mo»«mi mathvariant=¨bold¨»a«/mi»«mo mathvariant=¨bold¨»§#xA0;«/mo»«mi mathvariant=¨bold¨»dilui§#xE7;§#xE3;o«/mi»«mo mathvariant=¨bold¨»)«/mo»«/mstyle»«/math»](https://anglo.plurall.net/sites/all/libraries/ckeditor//plugins/ckeditor_wiris/integration/showimage.php?formula=cf05c2f7b8363f195a73e99bb897ab69.png)
